
Моделирование эпидемий: дополнения к модели SIR
by Алла Лосева
Наукометрия обычно упоминается в связи с оценкой цитируемости, но базы Web of Science и Scopus ученые всего мира используют не для этого, а для информационного поиска. По итогам такого поиска строятся карты науки — наглядное отражение того, как устроены исследовательские области, и какие работы в них центральные. Блог Pandemic Science Maps показывает, как устроена наука об эпидемиях в отдельных ее разделах. Редакторы блога — Даниил Александров и Алла Лосева.
Чтобы предсказать охват и длительность эпидемии, учёные прибегают к моделированию передачи вируса в обществе. Модели могут быть в разной степени детальными. Некоторые из них описывают только заражение и выздоровление: если кто-то переносит инфекцию, то определённая доля людей без иммунитета заразится, доля заразившихся — выздоровеет. Другие модели учитывают дополнительные факторы, такие как иммунитет, приобретённый через вакцинацию. Разумеется, эту последнюю корректировку можно включить в модель, только если вакцина от вируса существует. Поэтому детальность модели напрямую зависит от инфекции, распространение которой она призвана отражать.
Это наш второй материал про моделирование эпидемий. В первом мы рассматривали простейшую модель под названием SIR. Она подразумевает, что в любой момент времени общество делится на три группы, или класса, между которыми люди последовательно перемещаются по ходу эпидемии. Название модели — это аббревиатура названий классов: S — уязвимые, то есть без иммунитета к болезни (susceptible), I — заразившиеся и распространяющие вирус (infectious), и R — выздоровевшие и получившие иммунитет (recovered). Из-за деления общества на классы модель SIR называется компартментальной (от англ. compartment — отсек).
Модель SIR хорошо отражает реальность только в случае, если не нужно моделировать дополнительные процессы, например, угасание иммунитета со временем и повторное заболевание, или передачу вируса не от человека к человеку, а через животных-носителей или с водой. Поэтому простая модель SIR хорошо применима к болезням, после которых сохраняется пожизненный иммунитет: корь, краснуха, эпидемический паротит.
Сегодня мы рассмотрим компартментальные модели с дополнительными классами, которые предназначены для моделирования других типов заболеваний. Чаще всего используются следующие классы:
- E — заразившиеся и находящиеся в инкубационном периоде, не распространяя инфекцию (exposed). Модель SEIR, соответственно, помогает моделировать распространение инфекций, которые проявляются не сразу.
- C — переболевшие, но продолжающие распространять инфекцию (carrier). Модель carrier state используется для моделирования таких инфекций, которые могут переходить в хроническую стадию, так что переболевший продолжает заражать других. Это, например, случай гепатита B (Cao et al. 2014).
- D — умершие от болезни (dead). Этот класс будет особенно важен в моделях распространения заболеваний с высокой смертностью, например, таких, как лихорадка Эбола.
- M — наделённые иммунитетом от рождения (maternally derived immunity). Модели MSEIR иногда весьма сложные, потому что учитывают процесс постепенного угасания иммунитета и, соответственно, возрастающую вероятность заразиться.
Например, модель SEIS означает, что индивиды изначально являются уязвимыми для вируса (S), затем кто-то из них заражается и вступает в инкубационный период болезни (E), после чего человек начинает заражать других (I), но в конечном итоге снова переходит в класс уязвимых — если иммунитет к болезни не вырабатывается.
Возможны и другие варианты перемещений между классами модели:
- SIRS: для заболеваний, после которых остаётся временный иммунитет, и выздоровевшие индивиды через какое-то время снова становятся уязвимыми;
- SIS: упрощённая модель для болезней, к которым не вырабатывается иммунитет — например, ОРВИ;
- модели с вакцинацией: когда часть уязвимых людей (S) сразу перемещается в класс R, который теперь расшифровывается как «защищённые» (resistant).
Кроме того, разные наборы классов могут использоваться в разных типах моделей. Стандартные эпидемиологические модели строятся на обыкновенных дифференциальных уравнениях, которые описывают соотношение людей в разных классах в каждый момент времени. Однако в таких моделях не учитываются важные детали: разная степень уязвимости людей к вирусу, или закономерности локальных контактов между людьми (White, del Rey, and Sánchez 2007). Поэтому разрабатываются модели, которые не только включают разные классы людей, но и особенности их взаимодействий: например, модели на сетях, клеточные автоматы и агентные модели, вероятностные модели, пространственные и демографические.
Рассмотрим карту публикаций, в которых используются различные вариации модели SIR. Для обзора мы выполнили систематический поиск литературы в базе данных Scopus и построили карту публикаций на основе их списков литературы. Близость на карте и принадлежность к одному кластеру на этой карте означают, что публикации ссылаются на одни и те же работы — а значит, есть вероятность, что в статьях поднимаются схожие темы. Карта выполнена в программе VOSviewer.
Исследования, в которых применяются вариации модели SIR, делятся на семь кластеров:
- оранжевый, слева вверху, и синий, слева внизу: возрастные группы и вакцинация,
- серый, слева: пространственные модели эпидемии,
- голубой, вверху: случайные процессы,
- фиолетовый, по центру: обобщённые модели,
- цвета морской волны, справа внизу: модели на сетях,
- жёлтый, по центру внизу: модели на реальных данных.
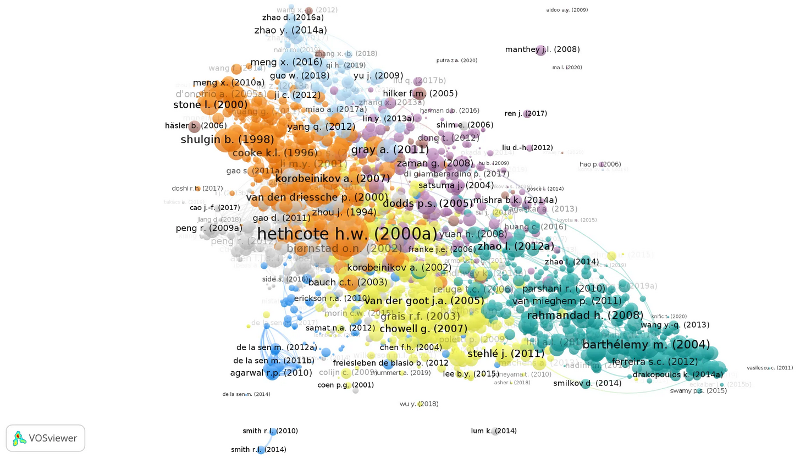
Цвет присвоен узлам в соответствии с автоматически выделенными кластерами. Связи означают, что в библиографиях публикаций есть одинаковые документы. Близость на карте и принадлежность к одному кластеру отражают вероятность, что в работах поднимаются схожие темы. Размер узла соответствует количеству цитирования публикации по данным Scopus. На карте отображены только связанные друг с другом документы (N = 2772).
Описание кластеров
Оранжевый и синий кластеры: возрастные группы и вакцинация
Реалистичные модели заражения должны учитывать возрастную структуру населения, — подчёркивает автор самой заметной работы в этом кластере и во всей карте (Hethcote 2000). Например, потому, что в разных возрастах люди по-разному взаимодействуют друг с другом: школьники ежедневно общаются с большим количеством других школьников, а люди в возрасте — нерегулярно и с меньшим числом людей. Также с возрастом иногда меняются риски заразиться и выздороветь, и вакцинацию люди тоже проходят в определённом возрасте (Korobeinikov 2007). А если в модель включают естественные прирост и убыль населения, то и их величина будет зависеть от возраста индивидов.
Такие модели порой используются для того, чтобы определять оптимальный возраст и стратегию вакцинации. Например, исследование de Blasio, Iversen, and Tomba (2012) из синего кластера показывает, что во время эпидемии свиного гриппа 2009 года в Норвегии, для лучшего результата, следовало начинать вакцинацию на 6 недель раньше. Но если бы сначала прививали детей, среди которых заболеваемость была выше, то того же результата можно было бы добиться, начав вакцинацию раньше на 5 недель. То есть вакцинация, направленная на группы риска, эффективна даже с небольшим опозданием.
В первом обзоре про моделирование эпидемий мы уже упоминали исследования о циклической вакцинации — они появляются и на этой карте, как, например, исследования Shulgin, Stone, and Agur (1998) и Stone, Shulgin, and Agur (2000) в оранжевом кластере.
Циклическая, или импульсная вакцинация (pulse vaccination) предполагает, что вакцинируются представители некой возрастной группы — группы риска, например, дети от 5 до 16 лет. Через какое-то время члены этой же возрастной группы прививаются повторно, и так продолжается с определённым интервалом между циклами вакцинации.
Эта стратегия отличается от общей вакцинации, через которую проходят почти все люди, например, в шесть лет. И если с помощью общей вакцинации можно победить эпидемию, только если привито подавляющее большинство населения (скажем, для кори это 95%), то циклическая вакцинация эффективна даже при меньшем охвате (Gao et al. 2006).
Shulgin, Stone, and Agur (1998) изучают, как проведение циклической вакцинации влияет на распространение заболеваний, которые зависят от смены сезонов — в связи с погодой или началом учебного периода. Исследователи приходят к выводу, что эта стратегия вакцинации может остановить распространение сезонных болезней. Однако они рекомендуют совмещать стратегии: общая вакцинация с большим охватом снижает число уязвимого населения, а циклическая вакцинация с меньшим охватом и длинными интервалами между циклами (до пяти лет) останавливает периодически возникающие вирусы. Некоторые работы синего кластера посвящены смешанным стратегиям вакцинации в более сложных моделях — например, с учётом рождаемости (de la Sen et al. 2010).
Серый кластер: пространственные модели эпидемии
Публикации этого кластера рассматривают, как инфекция передаётся в пространстве. Из-за того что вводится пространственное измерение, для простоты в самой модели оставляют только два класса: заразившиеся (I) и уязвимые (S). Между классами люди перемещаются по модели SIS, то есть с выздоровлением иммунитет не приобретается и переболевшие люди вновь уязвимы к вирусу.
Предполагается, что пространство неоднородно, в нём могут быть участки (patches) с большим и меньшим риском заразиться, и индивиды могут перемещаться между ними. Риски заразиться меньше при высоких темпах выздоровления или при низких уровнях передачи инфекции — например, при соблюдении физического дистанцирования (Sun et al. 2011). Если такие «безопасные зоны» существуют, а перемещения индивидов ограничены, то становится возможным остановить эпидемию по крайней мере в этих зонах (Allen et al. 2008). Чтобы контролировать эпидемию на всём пространстве, ограничивать следует перемещение не заражённых, а именно уязвимых людей, чтобы они меньше контактировали с заражёнными (Peng 2009).
Голубой кластер: случайные процессы
Передачу вируса можно моделировать как детерминированный процесс — линейную закономерность, где уязвимые становятся заражёнными, а заражённые выздоравливают, при этом чем больше заразившихся и уязвимых, тем больше человек заразится. А можно считать, что это в какой-то мере случайный процесс, и число новых заразившихся не прямо пропорционально числу заражённых и уязвимых. Чтобы это учесть, в модель вводят вероятности и так называемый шум (случайные факторы), и она из детерминированной превращается в стохастическую, то есть случайную.
Такой подход применяется в публикациях голубого кластера. В самых цитируемых работах исследуются условия, при которых в стохастической модели распространение заболевания прекращается либо болезнь навсегда остаётся в популяции (Gray et al. 2011). Рассматриваются также ситуации, когда распространяются одновременно две инфекции, нейтрализующие друг друга (Meng et al. 2016), и модели, где учитывается вакцинация или лечение (Zhao, Jiang, and O’Regan 2013; Zhao and Jiang 2014).
Фиолетовый кластер: обобщённые модели
В этом кластере собраны работы, где модели приводятся к более общим случаям (Satsuma et al. 2004). Например, Feng, Xu, and Zhao (2007) отмечают, что для моделирования карантина и изоляции не подходят модели с экспоненциальным ростом числа заражённых, и выводят более общий класс моделей с реалистичным распределением индивидов по стадиям болезни.
Самая заметная публикация в кластере объединяет существующие модели распространения инфекций и социальных воздействий, таких как слухи (Dodds and Watts 2005). В общей модели у индивидов появляется память о воздействии, варьируется «доза» воздействия, а также степень чувствительности к воздействию. Оказывается, что память о воздействии, то есть возможность накапливать «дозу», в наибольшей степени влияет на картину эпидемии.
Gomes, White, and Medley (2004) моделируют более широкий спектр видов иммунитета: временный иммунитет (который исчезает со временем) и частичный (который снижает риск повторной инфекции, но не исключает её). Исследователи обнаруживают, что из-за временного иммунитета промежутки между эпидемиями короче, и навсегда избавиться от инфекции сложнее. Из модели с частичным иммунитетом делается вывод, что снизить заболеваемость помогают вакцины, которые сильнее, чем полученный от болезни иммунитет.
Здесь представлен и такой метод моделирования эпидемий, как клеточный автомат (White, del Rey, and Sánchez 2007). Представьте, что вирус распространяется в двумерном пространстве, разбитом на одинаковые участки, которые меняют своё состояние исходя из простых правил. К примеру, если один из участков переходит в состояние «заражён», то и все его соседи на следующем шаге становятся «заражены». Такие локальные события меняют картину на макроуровне, и иногда можно наблюдать возникающие закономерности. Через модель клеточного автомата Liu and Jin (2005) обнаружили, что в сегрегированном пространстве эпидемия распространяется хуже.
Кроме того, в кластере находятся исследования о том, как вирус передаётся через окружающую среду: в закрытых помещениях (Noakes et al. 2006), через воду (Tien and Earn 2010) или, в случае животных, через биологические жидкости и экскременты (Bravo de Rueda et al. 2015).
Кластер цвета морской волны: модели на сетях
Для моделирования эпидемий можно пользоваться разным представлением о социальных сетях. Это могут быть случайные сети, где все узлы (люди) имеют равную вероятность соединиться со всеми (Gleeson 2011; Parshani, Carmi, and Havlin 2010).
Другой вариант — безмасштабные сети, где у большинства узлов мало связей и только у небольшого количества их много. Про безмасштабные сети известно, что в них эпидемии распространяются очень быстро, поскольку люди, у которых связей много, передают инфекцию огромному количеству других людей (Barthélemy et al. 2004). Превратится ли болезнь в эпидемию, зависит в том числе от плотности сети контактов первых заразившихся (Moreno and Vázquez 2003).
Однако значение имеет не только пространственная структура сети. Например, Rocha, Liljeros, and Holme (2011) обнаружили, что при моделировании заболеваний, передающихся половым путём, важна и временна́я структура взаимодействий.
Можно к тому же представлять сети как адаптивные, то есть их структура будет меняться по ходу эпидемии (Marceau et al. 2010). Есть и ещё более сложные модели сети: несколько публикаций отмечают, что N-переплетённая (N-intertwined) модель (Ferreira, Castellano and Pastor-Satorras, 2012) имеет преимущества по сравнению с моделями, основанными на марковских цепях (Van Mieghem, 2010).
В этом кластере собраны также публикации, где моделируется передача положительных и отрицательных эмоциональных состояний (Hill et al. 2010), распространение слухов (Trpevski, Tang and Kocarev, 2010; Zhao et al. 2012) и компьютерных вирусов (Yuan and Chen 2008).
Жёлтый кластер: модели на реальных данных
Здесь собраны разноплановые публикации. Часть из них посвящены пандемиям гриппа и включают демографические данные и данные об объёмах международных перелётов (Chowell, Nishiura, and Bettencourt 2007; Grais, Hugh Ellis, and Glass 2003). К примеру, Ciofi degli Atti et al. (2008) используют данные переписи населения, чтобы смоделировать на уровне домохозяйств перемещения между домом, школой и работой. Благодаря такой модели исследователи демонстрируют, как распространялся бы грипп по Италии в условиях пандемии, и как на это повлияли бы вакцинация и ограничение социальных контактов.
Hansen and Day (2011) также моделируют стратегии контроля эпидемии — что важно, при ограниченных ресурсах, — и показывают, в какой момент оптимально вводить различные меры контроля или их комбинацию.
С недавнего времени исследователи могут собирать очень детальные данные о контактах между людьми, с информацией о времени каждого взаимодействия. Но моделировать эпидемии на полной динамической сети не всегда удобно, и исследователи ищут способы, как гармонично дополнить модель такими данными. Например, Stehlé et al. (2011) обнаруживают, что довольно точно динамику эпидемии в полной сети воспроизводит сеть контактов, в которой учитывается их ежедневная продолжительность. Machens et al. (2013) получают хороший результат на сети, где сохранены вероятности контактов, а вот средняя продолжительность контактов за всё время значительно хуже воспроизводит динамику распространения вируса.