'렘데시비르' 미 국립보건원 임상결과 코로나19 표준치료제로 인정
환자 회복기간 31% 단축…“팬데믹 상황에서 매우 의미있는 효과”
이번 개념증명 후 2세대·3세대 치료제 개발 기대
by (서울=뉴스1) 성재준 바이오전문기자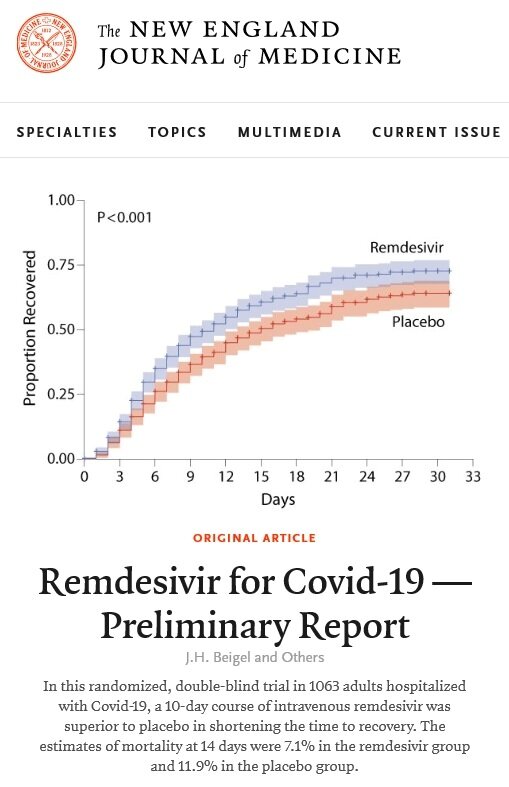
신종 코로나바이러스 감염증(코로나19) 치료제 후보물질인 '렘데시비르'가 코로나19 환자들의 치료기간을 31% 단축한 글로벌 임상시험이 공개됐다.
렘데시비르는 이번 임상시험 결과를 바탕으로 코로나19 표준 치료제로 인정 받았다는 평가다.
오명돈 서울대병원 감염내과 교수는 25일 미국 국립보건원(NIH)이 주도한 렘데시비르가 임상시험에서 치료군의 회복시간을 31% 단축한 결과가 지난 23일(현지시간) 공개됐다고 밝혔다.
임상시험은 전 세계적으로 미국에서 45개, 유럽과 아시아에서 28개 의료기관이 참여했다. 아시아에서는 한국, 일본, 싱가포르가 참여했다.
국내에서 진행된 NIH의 렘데시비르는 오 교수의 총괄하에 서울대학교병원, 분당서울대학교병원 그리고 서울 보라매병원이 참여했다.
임상시험은 코로나19환자 1063명을 대상으로 이중맹검, 위약대조 방식으로 설계됐다. 총 10일간 렘데시비르 또는 위약을 투여했으며 렘데시비르 투약군이 환자들의 치료시간을 15일에서 11일로 단축하면서 약 31% 앞당겼음을 확인했다.
회복된 환자는 퇴원이 가능하거나 입원 중이라도 산소치료가 필요없는 상태다.
오 교수는 "회복이 4일간 단축됐다는 것은 인공호흡기나 중환자실, 산소치료 같은 의료 자원이 그 만큼 더 많아지는 효과가 있어 의료 시설과 기구가 절실히 필요한 팬데믹 상황에서는 매우 의미있는 효과"라고 평가했다.
렘데시비르는 해당 결과를 근거로 지난 1일 미국 식품의약국(FDA)로부터 산소치료가 필요한 중증 코로나19 환자들에 긴급사용허가를 획득했다.
이번 임상시험 전에도 중국과 제조사인 길리어드에서 렘데시비르의 임상시험을 진행했다.
서울대병원은 "이번 NIH 주도 임상연구를 통해 렘데시비르가 코로나19의 표준 치료제로 인정받았다고 평가했다"며 "이번 렘데시비르 임상시험은 개념증명(PoC)을 제공했고 앞으로 렘데시비르가 표적으로하는 RNA 중합효소를 더욱 효과적으로 억제하는 제2세대, 3세대 약물이 나올 것으로 기대한다"
또한 "바이러스 증식 과정의 다른 부위를 타깃으로 하는 항바이러스제와 인체의 면역기능을 조절하는 약제들도 앞으로 개발될 것으로 기대한다"고 밝혔다.
jjsung@news1.kr